Các loại vaccine CSFV
MỤC LỤC BÀI VIẾT
1. Tổng quan
CSF (Classical swine fever): Bệnh dịch tả lợn cổ điển gây ra bởi 1 loại virus RNA thuộc chi Pestivirus thuộc họ Flaviviridae, chứa một kiểu huyết thanh được chia thành ba kiểu gen chính, bao gồm nhiều kiểu gen phụ. ( virus tả heo được chia thành 3 kiểu gen chính và 14 kiểu gen phụ của CSFV đã được báo cáo cho đến nay và sự thay đổi trong các kiểu gen lịch sử 1–2 đã được quan sát thấy trong quá khứ gần đây) [1]. Sự lây truyền: Bệnh lây lan do truyền trực tiếp chủ yếu qua đường tiêu hóa hay đường hô hấp phía trên từ con ốm sang con khỏe. Từ đó virut vào thực bào và đến các hạch lympho như tuyến amidan, họng… và tăng sinh. Sau 24 giờ, virut thâm nhập vào máu và xâm nhiễm các tế bào nội mạc mạch máu. Sau 3 – 4 ngày virut tới các cơ quan nhu mô và rồi lại tăng sinh và nhiễm huyết lần hai vào ngày thứ 5 – 6. Virut gây bệnh dịch tả qua màng nhau thai và tấn công bào thai ây sẩy thai, đẻ non hay chết lưu, hoặc đẻ ra lợn con nhiễm virut máu và không tạo được kháng thể [2].
Cấu trúc virus:
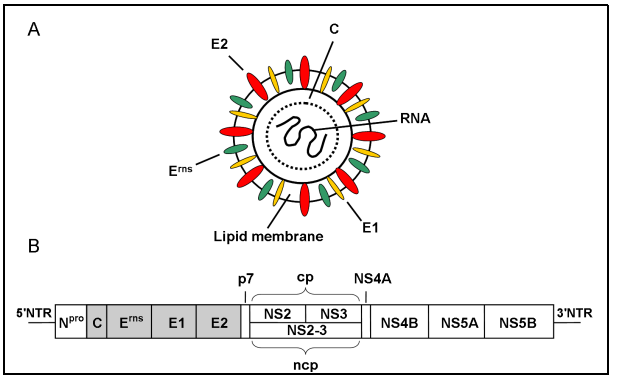
Protein phi cấu trúc: NS2, NS3, NS4B, NS5A, NS5B
Protein cấu trúc:
– Glycoprotein Erns, E2, E1 nằm ở vỏ ngoài của virus và có chức năng quan trọng trong vệc lây nhiễm; Cả Erns và E2 được biết là tạo ra các kháng thể trung hòa virus mà cung cấp khả năng miễn dịch bảo vệ trong vật chủ tự nhiên [3]
– Glycoprotein E2 là mục tiêu chính của các kháng thể trung hòa được tạo ra trong quá trình nhiễm CSFV và được coi là protein kháng nguyên chính trên thị trường vắc xin [4].
– Erns góp phần quyết định độc lực CSFV, tham gia vào việc kết dính và xâm nhập vào tế bào cảm nhiễm. Ngoài chức năng là một protein cấu trúc liên kết với vỏ bọc, Erns còn hỗ trợ bài thải virus qua một màng đặc biệt E rns có khả năng gây ra chết tế bào lypho [5] [6]. Có nhiều ý nghĩa trong việc tạo vaccine và chẩn đoán huyết thanh học. Erns được coi là glycoprotein thứ hai tạo ra kháng thể trung hòa virus [7].
– Protein E1: Vai trò quan trọng trong việc xâm nhập của virus vào tế bào chủ như gắn vào các thụ thể của tế bào chủ, xâm nhập, lắp ráp các thế hệ virus mới được sản xuất và thoát ra. Sự biến đổi vị trí glycosyl hóa trong protein vỏ E1 tạo ra virus giảm độc lực để chế tạo vaccine giảm độc lực.
– Protein lõi C: Vai trò quan trong trong việc nhân bản của viurs.
Vaccine CSFV
Việc đầu tiên là chuẩn đoán sớm để lập vùng để có áp dụng các biện pháp dập dịch. Ngay khi phương pháp chuẩn đoán được xây dựng, việc tiếp theo cần thực hiện là ngăn chặn bằng một loại vaccin và chương trình tiêm phòng chắc chắn, loại thải sớm heo mắc bệnh. Mặc dù vaccine nhược dộc an toàn và có hiệu quả chống lại dịch tả heo nhưng nhược điểm chúng ta không thể phân biệt được giữa heo được chủng bằng vaccine nhược độc và heo bị nhiễm virus thực địa.
Cộng đồng châu Âu cũng đã nỗ lực tìm ra các vaccin phòng bệnh và chọn ra những con heo bị nhiễm với hy vọng có thể dập tắc được dịch. Tuy nhiên, điều đó không thể thực hiện được vì lý do không thể phân biệt được heo nhiễm từ vaccin. Do đó, vaccin đã cấm sử dụng cuối năm 1990 trước khi thị trường chung trong nội địa châu Âu được thiết lập, chỉ cho phép buôn bán sản phẩm từ heo không có kháng thể kháng CSFV. Những qui định khắc khe đã ảnh hưởng việc buôn bán các sản phẩm từ heo ở các quốc gia có sử dụng vaccin.
Cho nên, ở các nước châu Âu đã cố gắng tìm ra loại vaccin mới với đặc tính có khả năng phân biệt được heo nhiễm CSFV do vaccin hay tự nhiên (DIVA), và đồng thời cũng phát triển phương pháp chuẩn đoán để phát hiện sớm các heo bị nhiễm CSFV. Công nghệ tái tổ hợp dã cho phép dã cho phép tạo ra loại vaccin tái tổ hợp đáp ứng được những yêu cầu trên, và cùng với đó là các bộ test để phát hiện phân biệt heo được tiêm vaccine và heo không tiêm vaccine. Vaccine phân biệt được với chủng tự nhiên là được gọi là vaccine đánh dấu.
Ba protein tạo ra các kháng thể có thể phát hiện được: E2 (Protetin miễn dịch chính, tạo kháng thể trung hòa), Erns (hoạt động trung hòa thấp hoặc không có) và NS3 (không có hoạt động trung hòa). Đối với chẩn đoán vaccine đánh dấu, việc phát hiện các kháng thể chống lại các protein sinh miễn dịch như protein vỏ Erns hoặc E2 và protein phi cấu trúc NS3 có thể được sử dụng. Tuy nhiên, vì E2 là protein sinh miễn dịch chính và là một phần của nhiều loại vắc-xin CSF, nên các xét nghiệm đánh dấu CSF vaccine được phát triển gần đây đã được thiết kế để phát hiện các kháng thể đặc hiệu với Erns. Do tính ổn định di truyền cao của protein NS3 và chúng cũng có ở các virus không gây bệnh trên heo nên việc phát hiện các kháng thể đặc hiệu của NS3 ít phù hợp hơn đối với xét nghiệm liên quan đến huyết thanh đặc hiệu của CSFV [8].
2. Vaccine sống giảm độc lực
2.1 LOM vaccine
Chủng LOM có nguồn gốc từ chủng Miyagi có độc lực thấp được phân lập ở Nhật Bản vào năm 1956 và được làm giảm độc lực hơn nữa thông qua việc cấy truyền liên tục trong tế bào thận bò. Chủng LOM lần đầu tiên được thử nghiệm như một ứng cử viên vắc-xin từ năm 1968 đến năm 1969 tại Viện Nghiên cứu Thú y (IVR) ở Hàn Quốc. Sau đó, vắc xin sống giảm độc lực được sử dụng rộng rãi trong cả nước để diệt trừ CSFV từ năm 1974. Thực tế là vắc-xin LOM đã được sử dụng ở Hàn Quốc trong nhiều năm, chỉ ra rằng vắc-xin này có lẽ an toàn với đáp ứng miễn dịch cao ở lợn tuy nhiên, trong nhiều thập kỷ, các đợt bùng phát lẻ tẻ của CSF đã xảy ra liên tục .
Ngoài ra, mặc gì chủng LOM đã được giảm độc lực trong tế bào thận bò/lợn và mặc dù chủng này đã được coi là ổn định về mặt di truyền, những chúng có khả năng phục hồi độc lực. Thật vậy, sau khi vô ý tiêm chủng vắc-xin LOM vào năm 2014, CSFV tái xuất hiện ở đảo Jeju, Hàn Quốc, nơi từng là khu vực không có CSF với chính sách không tiêm chủng trong một thập kỷ. Kể từ khi tái xuất hiện, bùng phát CSFV đã xảy ra trên đảo, gây thiệt hại to lớn cho các trang trại lợn [9].
2.2 Vaccine chủng C
Vắc-xin chủng C đã được coi là một trong những vắc-xin CSF hiệu quả nhất được sử dụng trên toàn thế giới để kiểm soát CSF. Chủng C được phát triển bởi Viện nghiên cứu Trung Quốc Kiểm soát thuốc thú y và Viện nghiên cứu thú y Cáp Nhĩ Tân năm 1956. Khả năng miễn dịch do các chủng C mang lại đã được nghiên cứu và cho thấy đáp ứng miễn dịch lâu dài, tồn tại trong khoảng thời gian từ 6 đến 11 tháng hoặc thậm chí suốt đời. Việc tiêm phòng bằng chủng C đã được chứng minh là mang lại sự bảo vệ lâm sàng đầy đủ (không có sự phát tán của virus). vắc-xin chủng C không hồi phục độc lực của chúng, ngay cả sau 30 nuôi cấy liên tiếp trên lợn. Nên loại vắc xin này vẫn là một trong những loại vắc xin thích hợp nhất để sử dụng cho mục đích kiểm soát chủ yếu ở các nước kém phát triển vì bên cạnh mức độ cao của hiệu quả và an toàn, việc sản xuất các loại vắc-xin này dễ thực hiện về mặt công nghệ [9].
2.3 GPE-Strain
Vắc-xin chủng GPE-Strain được phát triển ở Nhật Bản. Chủng vắc-xin giảm độc lực này được lấy từ chủng ALD hoang dại qua nhiều đời nuôi cấy và nhân bản trong tế bào tinh hoàn lợn, tinh hoàn bò và tế bào thận sơ cấp của chuột lang. Lợn được tiêm vắc-xin GPE không xuất hiện các triệu chứng lâm sàng như chán ăn và sốt, chủng GPE hiếm khi sản xuất virus trong máu ở động vật được tiêm và không cho thấy bằng chứng về sự phát tán trong bài tiết. Hơn nữa, vắc-xin dựa trên chủng GPE đã được chứng minh là an toàn trong lợn nái mang thai, lợn sơ sinh và lợn trưởng thành. Một nghiên cứu gần đây đã cảnh báo cộng đồng khoa học về khả năng trở lại độc lực của chủng virus GPE sau 11 lần lây truyền liên tiếp ở lợn. Bất chấp nguy cơ phát hiện mới này phát sinh vắc-xin dựa trên GPE strain của Nhật Bản đã được sử dụng ở các nước Châu Á và Thái Bình Dương trong nhiều thập kỷ [9].
2.4 Chủng Thiverval
Chủng vắc-xin Thiverval được phân lập từ chủng CSFV Alfort thông qua hơn 170 lần nuôi cấy trong tế bào ở 29–30 ◦C. Vắc xin này đã được cấp bằng sáng chế ở Pháp khoảng năm 1971, đã cho thấy sự ổn định di truyền và mức độ an toàn cao ngay cả khi đã được áp dụng trên động vật bị ức chế miễn dịch. Ngoài ra, chủng vắc-xin Thiverval đã không có hiện tượng phục hồi độc lực. Có nhiều nghiên cứu chỉ ra Vắc-xin Thiverval đã cho thấy mức độ hiệu quả, an toàn cao cũng như khả năng ngăn chặn sự lây truyền dọc của CSFV khi sử dụng cho lợn nái mang thai [9].
2.5 Chủng PAV-250
Chủng PAV-250 có nguồn gốc từ chủng CSFV A bị suy giảm độc lực trong dòng tế bào PK15. Vắc xin sống giảm độc lực này đã được sử dụng thành công trong chương trình kiểm soát và diệt trừ CSF ở Mexico từ năm 1979. Giống như các vắc-xin sống giảm độc lực khác PAV-250 đã được chứng minh là an toàn trên heo nái mang thai. Với khả năng kháng nguyên của PAV-250 để tạo ra phản ứng miễn dịch mạnh mẽ, vắc-xin này Đã cho thấy tính ổn định di truyền cao, không có khả năng lây truyền và khả năng bảo vệ chống lại các chủng CSFV có độc lực khác nhau [64,65].Vắc xin PAV-250 cũng không có dấu hiệu trở lại độc lực
Nói chung, vắc-xin sống giảm độc lực chống lại CSFV có một số ưu điểm, bao gồm an toàn, phạm vi bảo vệ rộng nhưng nhược điểm lớn của loại vắc xin này là không thể phân biệt giữa động vật bị nhiễm bệnh và động vật được tiêm phòng Do đó, chiến lược tiêm chủng này không tránh khỏi việc hạn chế thương mại đối với những quốc gia áp dụng vắc xin sống giảm độc lực để kiểm soát CSF. Do đó, để giải quyết vấn đề này, các nhóm nghiên cứu trên khắp thế giới đang không ngừng nghiên cứu viên vắc-xin mới chống lại CSFV nhưng có khả năng phân biệt giữa động vật được tiêm vaccine và động vật bị nhiễm tự nhiên. Những loại vaccine đó được gọi là Vaccine DIVA hay vaccine đánh dấu [9].
3. Vaccine đánh dấu
3.1 Vaccine tiểu phần
Một lựa chọn phổ biến của vắc-xin đánh dấu là sử dụng protein E2, được coi là protein vi-rút gây miễn dịch mạnh nhất của CSFV. Thế hệ đầu tiên của vắc-xin tái tổ hợp được công nhận trong tài liệu khoa học là vắc-xin tiểu đơn vị E2. E2-protein là thành phần chính glycoprotein cấu trúc virus, được coi là một thành phần thiết yếu của vỏ virus và đóng một vai trò quan trọng trong quá trình lây nhiễm vi-rút vì cùng với E1-protein tham gia gắn thụ thể của virus với thụ thể tế bào. E2 có tính sinh miễn dịch cao và nó có liên quan đến việc tạo ra các kháng thể trung hòa, có vai trò bảo vệ chống lại sự lây nhiễm của virus. Những yếu tố này chỉ ra rằng glycoprotein E2 là một ứng cử viên lý tưởng cho sự phát triển của các chiến lược khác nhau của vắc-xin tái tổ hợp chống lại CSFV. Protein E2 được biểu hiện bởi hệ thống baculovirus trong tế bào côn trùng. Một trong những ưu điểm chính của hệ thống biểu hiện baculovirus là khả năng giống với kiểu glycosyl hóa tự nhiên của E2, đó là một yếu tố quan trọng để kích hoạt hệ thống miễn dịch. Vắc xin tiểu đơn vị E2 đã được Cơ quan Dược phẩm Châu Âu (EMEA) cấp phép [9].
Tuy nhiên, Vaccine tiểu đơn vị cho thấy khả năng việc xuất hiện muộn đáp ứng miễn dịch chính là nhược điểm của chúng. Để cung cấp khả năng bảo vệ tối ưu vắc-xin yêu cầu hai liều tiêm chủng nhưng vẫn tạo ra khả năng miễn dịch ngắn hơn so với vắc-xin sống giảm độc lực và chỉ kéo dài khoảng từ 6 đến 13 tháng. Bởi vì virus tiểu phần không có khả năng sao chép vào vật chủ do đó chúng không đủ điều kiện để uống khiến chúng không thích hợp cho các chương trình tiêm phòng bằng đường uống, nhắm vào các quần thể lợn rừng bị nhiễm bệnh đặc hữu có tầm quan trọng liên quan trong các chiến dịch tiêm chủng khẩn cấp. Vắc xin có ưu điểm lớn hơn vắc xin sống giảm độc lực về tính an toàn, vì chúng không sao chép, không có khả năng hổi độc lực và ổn định với nhiệt độ cao hơn so với vắc-xin sống.
3.2 Vắc xin đánh dấu sống
Vaccine Chimeric pestivirus là sự kết hợp của vắc-xin sống giảm độc lực với các đặc tính đánh dấu. Vắc xin đánh dấu Chimeric pestivirus CP7_E2alf được phát triển từ chủng virus CP7 gây bệnh tiêu chảy ở bò (BVDV) nhưng chúng được thiết kế để biểu hiện glycoprotein E1 và E2 của chủng CSFV Alfort/187. Vi-rút được thiết kế đã chứng minh tính hiệu quả và an toàn sau khi tiêm cho lợn nhà và quần thể lợn rừng với vắc-xin với 1 liều vaccine duy nhất và hiệu quả kéo dài trong vòng 6 tháng. vắc-xin CP7_E2alf không lây truyền và không bài tiết qua nước tiểu, phân hoặc tinh dịch [131] và virus chimeric ổn định về mặt di truyền như đã được nghiên cứu trong in vitro và in vivo.
Flc-LOM-BErns, một loại vắc-xin sống Chimeric pestivirus CSF khác, gần đây đã được được cấp phép bởi năm công ty vắc-xin thú y của Hàn Quốc vào năm 2016. Loại vắc-xin này đã được được phát triển bằng cách sử dụng bộ gen của chủng LOM. Trong đó loại bỏ trình tự Erns của capsid CSFV. Những vùng này đã được thay thế bằng trình tự gen Erns của virus gây bệnh tiêu chảy ở bò (BVDV) tạo ra vắc xin Flc-LOM-BErns . Theo các nghiên cứu gần đây, loại vắc-xin khảm mới này đã cho thấy cung cấp sự bảo vệ hoàn toàn cho lợn nái mang thai.
Việc sử dụng các loại pestivirus khác xa về mặt di truyền và kháng nguyên đối với CSFV đã xuất hiện như một lựa chọn hấp dẫn để tạo ra vacicne DIVA. Như vậy, ba loại vaccine virus khảm gần đây đã được phát triển bằng cách thay thế gen Erns của chủng CSFV Alfort Tübingen bằng gen tương đồng của các chủng pestivirus có họ hàng xa. Các virus khảm được thiết kế “Ra,” “Pro,” và “RaPro” chứa các trình tự Erns từ chuột [9].
3.3 Viral Vector hay Replicon Vaccines
RNA của virus RNA sợi dương đang trở thành công cụ mạnh mẽ để biểu hiện gen trong tế bào động vật có vú và để phát triển vắc-xin. Bộ gen virus không có khả năng sao chép để tạo ra virus truyền nhiễm do khiếm khuyết về chức năng, gây ra bởi việc xóa một phần hoặc toàn bộ ít nhất một gen cấu trúc. Các bản sao có thể được đóng gói vào vỏ của 1 virus vô hại để tạo ra các hạt virus (VRP). Do đó, VRP đáp ứng một trong các yêu cầu đối với vắc xin an toàn, vì chúng không thể lây truyền theo chiều ngang hoặc chiều dọc; dựa trên điều này, VRP không tạo ra thế hệ con cháu truyền nhiễm cũng làm giảm cơ hội xuất hiện vi rút độc lực từ vắc xin. Ngoài ra, VRP có lợi thế là sản xuất kháng nguyên kéo dài để tạo ra phản ứng tế bào T. Ngoài ra, loại vắc-xin này cho phép phân biệt động vật được tiêm vắc-xin VRP với động vật bị nhiễm bệnh dựa trên việc không có kháng thể chống lại (các) protein hoặc (các) epitope đã bị xóa trong VRP [9].