Những điều cần biết về xét nghiệm bệnh đậu mùa ở khỉ
Bệnh đậu mùa khỉ là 1 bệnh truyền nhiễm do virus gây nên. Vật chủ của bệnh được cho là loài gặm nhấm nhỏ (ví dụ loài sóc)- loài đặc hữu của Tây Phi, sau đó nó lan sang các khu vực khác trên thế giới hiện không phải là loài đặc hữu [1]. Trong khi bệnh đậu mùa khỉ được phát hiện lần đầu tiên vào năm 1958 và lần đầu tiên được xác định ở người vào năm 1970, nó vẫn chưa lây lan rộng rãi ra bên ngoài châu Phi cho đến nay [2]. Để ngăn chặn virus này lây lan thêm nữa, điều quan trọng là phải thực hiện các phương pháp chẩn đoán và xét nghiệm đáng tin cậy.
Virus đậu mùa khỉ (MPXV) thuộc giống Orthopoxvirus trong họ Poxviridae [2]. Hiện tại, có một số bộ kit PCR có thể sử dụng để phát hiện bệnh đậu mùa khỉ (MPXV) hoặc orthopoxvirus (OPXV) [1]. Hầu hết chúng chỉ được sử dụng cho nghiên cứu và không có tài liệu nào được xác nhận độc lập [1]. Điều này cho thấy rằng vẫn còn nhiều điều để cải thiện, đặc biệt là vì chẩn đoán triệu chứng trong trường hợp bệnh đậu mùa khỉ rất phức tạp [1].
Kiểm tra theo hướng dẫn của WHO (phương pháp PCR)
Lấy mẫu bệnh phẩm
Loại mẫu bệnh phẩm được khuyến nghị để xác nhận bệnh đậu mùa khỉ trong phòng thí nghiệm là các mẫu vật chứa vùng da thương tổn, bao gồm các miếng gạc có bề mặt da tổn thương hoặc dịch tiết, hoặc các lớp vảy tổn thương. Có thể sử dụng cả gạc khô và gạc được đặt trong môi trường vận chuyển virus (VTM). Hai tổn thương cùng loại nên được thu thập trong một ống duy nhất, tốt nhất nên lấy từ các vị trí khác nhau trên cơ thể và có biểu hiện khác nhau. Không được để lẫn các vết thương, lớp vảy và dịch mụn nước trong cùng một ống. Ngoài một bệnh phẩm tổn thương, việc lấy mẫu dịch hầu họng được khuyến khích. Tuy nhiên, dữ liệu về độ chính xác của loại bệnh phẩm này để chẩn đoán còn hạn chế đối với bệnh đậu khỉ, do đó cần thận trọng khi giải thích mẫu xét nghiệm ngoáy họng âm tính. [3]
Sinh phẩm xét nghiệm
Sinh phẩm xét nghiệm nên được bảo quản theo khuyến nghị của nhà sản xuất. Có một số bộ mồi và bộ đầu dò cho xét nghiệm PCR đối với OPXV và đặc biệt là MPXV đã được xuất bản trong tài liệu và có thể được sử dụng để phát triển nội bộ các xét nghiệm trong các phòng thí nghiệm có năng lực thích hợp [4] [5] [6]. Bộ dụng cụ PCR phát hiện OPXV hoặc cụ thể là MPXV đang được phát triển [7] [8], nhưng hiện chưa có bộ kit PCR hoặc huyết thanh học thương mại nào được cung cấp rộng rãi. Vật liệu kiểm soát tích cực cho các xét nghiệm PCR có thể được đặt hàng từ các sáng kiến chuyên ngành [9].
Có sự tập huấn để sử dụng thuốc thử:
Các chứng dương nên được để ở nồng độ thấp (trên giới hạn phát hiện), nhưng dễ phát hiện.
Có thể bổ sung các yếu tố kiểm soát chất lượng để hỗ trợ kiểm soát các yếu tố của quá trình xét nghiệm chẩn đoán
Yếu tố kiểm soát chất lượng cần cung cấp thông tin về
- Chất lượng mẫu
- Chất lượng axit nucleic
- Chất lượng quy trình.
PCR có thể cực kỳ nhạy cảm vì vậy cần cố gắng hạn chế sự lây nhiễm khi thực hiện.
Các biện pháp kiểm soát tiêu cực trong mỗi lần chạy phải được sử dụng để đảm bảo không xảy ra lay nhiễm.
Các kiểm soát tính toàn vẹn của mẫu (ví dụ RNase P), kiểm soát tách chiết, dương tính và ức chế có thể giúp phân biệt âm tính giả với âm tính thật.
Các biện pháp kiểm soát phải được sử dụng sau các quy trình vận hành tiêu chuẩn cho phòng thí nghiệm- SOPs. Nếu bất kỳ biện pháp kiểm soát xét nghiệm nào không đạt, phải lặp lại thử nghiệm. [3]
Khuyến nghị của Solis BioDyne để có kết quả tốt nhất.
Nồng độ 5x của sinh phẩm là có lợi, nếu bạn muốn thêm cỡ mẫu lớn hơn trong phản ứng.
Ưu điểm của hỗn hợp đậm đặc 5x:
- Nhiều phản ứng hơn từ cùng một khối lượng
- Thêm không gian cho mẫu tập trung thấp
- Thêm không gian cho mồi và đầu dò
- Ổn định tốt hơn
- Phù hợp nhất cho các phản ứng đa mồi
Điều này cho phép linh hoạt hơn với các phương pháp chuẩn bị mẫu đơn giản hơn trong đó DNA không được tinh chế và cô đặc, mà được lưu trữ trong bộ đệm vận chuyển (chủ yếu dựa trên PBS) và được thêm vào phản ứng với các bước tiền xử lý tối thiểu.
Một khía cạnh quan trọng khác là nguy cơ lây nhiễm chéo. Nó thực sự trở thành một vấn đề khi quy trình làm việc trở nên chuyên sâu hơn và các phương pháp an toàn thông thường là không đủ. Chúng tôi khuyên bạn nên giảm sự lây nhiễm chéo bằng cách sử dụng hỗn hợp PCR với UNG.
Nếu bạn đang chuẩn bị mẫu đơn giản hơn và nguyên liệu đầu vào chứa các chất ức chế khác nhau, thì thuốc thử PCR dung nạp chất ức chế có tầm quan trọng cao. Với các trường hợp này chúng tôi khuyến cáo sử dụng các sản phẩm qPCR SolisFAST® Probe.
Để đánh giá khả năng dung nạp chất ức chế của hỗn hợp qPCR SolisFAST®, một hệ thống thử nghiệm đã được tạo ra và đánh giá tác động của các chất ức chế riêng lẻ, chủ yếu được tìm thấy trong phản ứng PCR, đối với các sản phẩm. Chúng tôi đã sử dụng một quy trình nhanh cho các sản phẩm của mình.
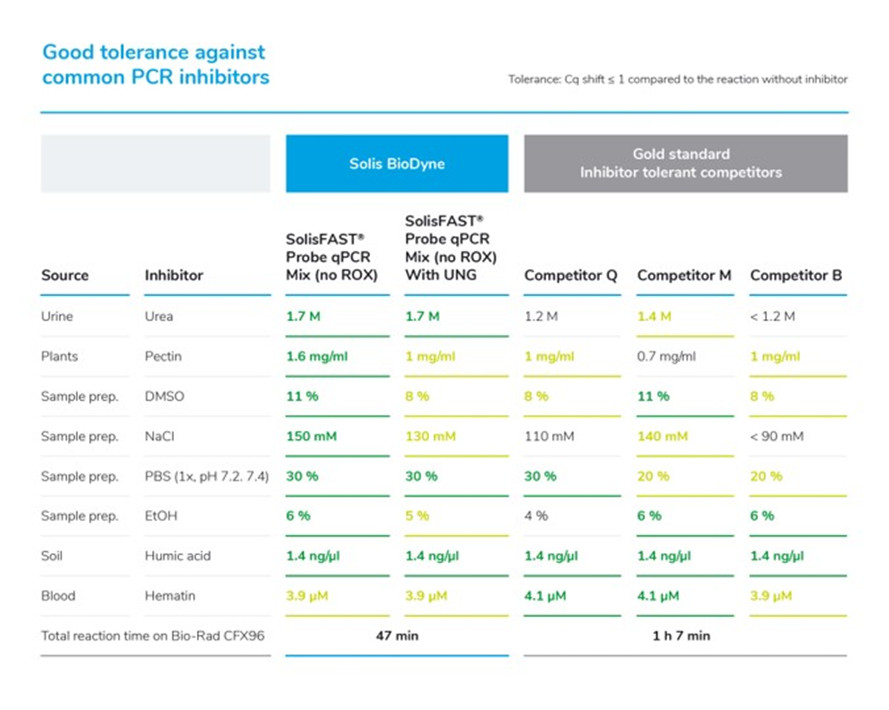
Dung nạp Urê có lợi cho việc chẩn đoán UTI-s (nhiễm trùng đường tiết niệu), STD-s (bệnh lây truyền qua đường tình dục) và cả các mẫu phân. Pectin là chất ức chế phổ biến trong các mẫu thực vật. DMSO thường được sử dụng trong các bước tiền xử lý mẫu và cũng như một chất tăng cường PCR. Để tận dụng tối đa những tác động tích cực của việc sử dụng DMSO, bản thân hiệu suất PCR không nên bị kìm hãm bởi nó. Do đó, khả năng chịu DMSO là một tính năng quan trọng. NaCl và PBS cũng là những chất ức chế phổ biến từ các bước chuẩn bị mẫu. Hiệu suất của chúng tôi ngang bằng với etanol, chất có thể dễ dàng trở thành tác nhân gây ô nhiễm cho phản ứng PCR, vì nó thường được sử dụng trong quá trình chuẩn bị mẫu và tách chiết DNA. Axit humic là một thách thức với các mẫu đất, cũng như các mẫu môi trường, nước thải, nước và đôi khi là thực vật. Cuối cùng nhưng không kém phần quan trọng, hematin có thể gây ra các vấn đề trong phân tích mẫu máu.
Các sản phẩm SolisFAST® Probe qPCR:
SolisFAST® Probe qPCR Mix
SolisFAST® Probe qPCR Trộn với UNG
(Tham khảo:
[1] Multi-country monkeypox outbreak: situation update. World Health Organization. Available from: https://www.who.int/emergencies/disease-outbreak-news/item/2022-DON390
[2] About Monkeypox. Centers for Disease Control and Prevention. Available from: https://www.cdc.gov/poxvirus/monkeypox/about.html
[3] Laboratory testing for the monkeypox virus: Interim guidance. World Health Organization. Available from: https://www.who.int/publications/i/item/WHO-MPX-laboratory-2022.1
[4] Li, Y., Zhao, H., Wilkins, K., Hughes, C., Damon, I. K. (2010). Real-time PCR assays for the specific detection of monkeypox virus West African and Congo Basin strain DNA. Journal of Virological Methods, 169(1):223–7.
[5] Schroeder, K., Nitsche, A. (2010). Multicolour, multiplex real-time PCR assay for the detection of human-pathogenic poxviruses. Molecular and Cellular Probes, 24(2):110–3.
[6] Maksyutov, R. A., Gavrilova, E. V., Shchelkunov, S. N. (2016). Species-specific differentiation of variola, monkeypox, and varicella-zoster viruses by multiplex real-time PCR assay. Journal of Virological Methods, 236:215–20.
[7] Li, D., Wilkins, K., McCollum, A. M., Osadebe, L., Kabamba, J., Nguete, B., et al. (2017). Evaluation of the GeneXpert for Human Monkeypox Diagnosis. Am J Trop Med Hyg, 96(2):405–10.
[8] Townsend, M. B., MacNeil, A., Reynolds, M. G., Hughes, C. M., Olson, V. A., Damon, I. K., et al. (2013). Evaluation of the Tetracore Orthopox BioThreat® antigen detection assay using laboratory grown orthopoxviruses and rash illness clinical specimens. Journal of Virological Methods, 187(1):37–42.
[9] European Virus Archive. Monkeypox virus. Available from: https://www.european-virus-archive.com/search/node/monkeypox.)