Tổng quan về PCR và 3 thế hệ PCR
Trong quá trình học hỏi, làm việc chúng ta thường gặp nhiều từ nói về công nghệ PCR khác nhau như qPCR, RT-PCR, RT-qPCR, real-time PCR, nhiều người cảm thấy ngợp và không hiểu các từ PCR này khác nhau như thế nào. Vậy bài viết hôm nay sẽ làm rõ về các PCR
MỤC LỤC BÀI VIẾT
1. PCR là gì?
Phản ứng chuỗi Polymerase (PCR), là một kỹ thuật sinh học phân tử để khuếch đại các đoạn DNA cụ thể trong ống nghiệm. Kể từ khi công nghệ PCR ra đời, công nghệ PCR đã đóng một vai trò to lớn trong khoa học sinh học, chẩn đoán phân tử, xét nghiệm huyết thông, nhận dạng pháp y và điều tra tội phạm. Đây là một trong những công nghệ quan trọng nhất của sinh học phân tử. Thông qua sự cải tiến và đổi mới, công nghệ PCR đã phát triển ba thế hệ: PCR, công nghệ PCR định lượng thời gian thực (qPCR) và công nghệ PCR kỹ thuật số (dPCR).
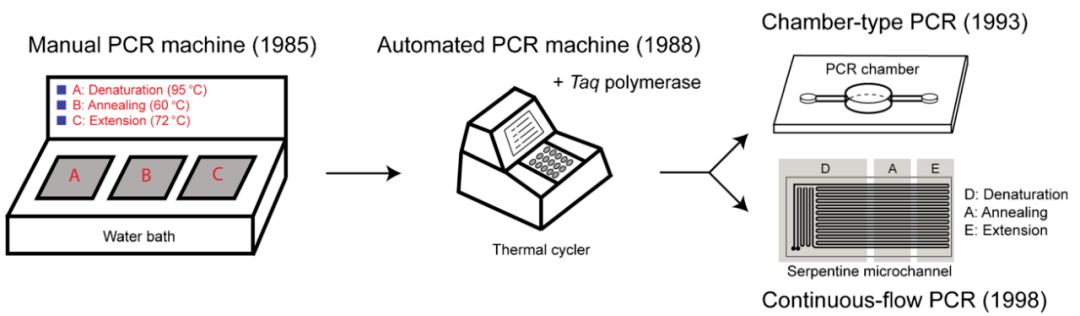
2. Nguyên lý PCR
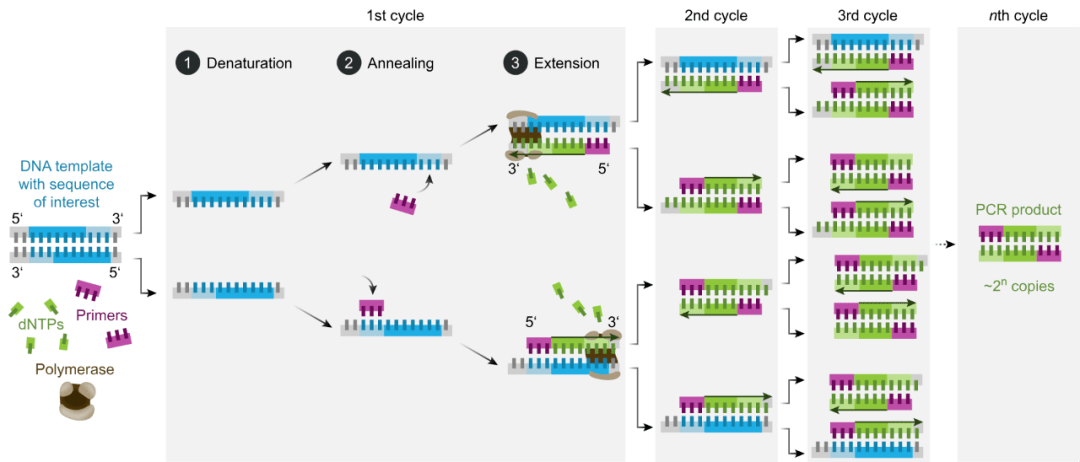
Nguyên lý cơ bản của PCR tương tự như nguyên lý sao chép DNA in vivo và tính đặc hiệu của nó phụ thuộc vào các đoạn mồi oligonucleotide bổ sung cho cả hai đầu của trình tự đích. PCR bao gồm ba bước phản ứng cơ bản: biến tính, ủ và mở rộng.
B1: Biến tính DNA mẫu: DNA mẫu được ủ ở nhiệt độ cao (khoảng 95 ° C) trong một khoảng thời gian nhất định để phân tách nó thành các chuỗi đơn để có thể liên kết với mồi.
B2: Bắt cặp mồi: khi nhiệt độ hạ xuống khoảng 55 ° C, mồi liên kết với chuỗi DNA đơn theo nguyên tắc ghép cặp bổ sung base.
B3: Mở rộng mồi: nhiệt độ sau đó được điều chỉnh đến khoảng 72 °C (nhiệt độ phản ứng tối ưu cho DNA polymerase), DNA và liên kết mồi được tổng hợp theo hướng 5’→3′ tạo chuỗi sao chép bảo tồn bổ sung cho chuỗi DNA mẫu dưới tác dụng của Taq DNA polymerase, theo nguyên tắc sao chép bắt cặp bazơ và sao chép bán bảo tồn. Điều này khuếch đại gen mục tiêu được khuếch đại vài triệu lần sau nhiều chu kỳ lặp lại biến tính, ủ và mở rộng.
3. Phân loại PCR
1) PCR:
PCR thế hệ đầu tiên khuếch đại các gen mục tiêu bằng cách sử dụng bộ khuếch đại PCR thông thường và các sản phẩm được phân tích định tính bằng phương pháp điện di trên gel agarose.
2) PCR định lượng thời gian thực, qPCR
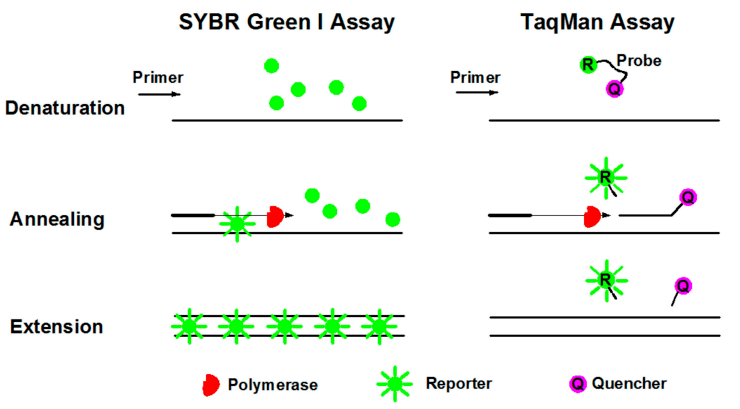
PCR thời gian thực định lượng hay còn gọi là PCR thời gian thực hay PCR thế hệ thứ hai là việc bổ sung thuốc nhuộm huỳnh quang hoặc nhóm huỳnh quang vào hệ thống phản ứng khuếch đại PCR, theo dõi sự thay đổi về lượng sản phẩm khuếch đại trong mỗi chu kỳ trong thời gian thực bằng cách thu thập tín hiệu huỳnh quang trong suốt quá trình PCR và cuối cùng định lượng các mẫu cần kiểm tra bằng đường cong tiêu chuẩn và giá trị CT. qPCR thường được sử dụng theo hai phương pháp là phương pháp SYBR Green và phương pháp thăm dò TaqMan.
a. Phương pháp nhuộm huỳnh quang (SYBR Green): SYBR Green Ⅰ là thuốc nhuộm huỳnh quang được sử dụng phổ biến nhất trong PCR định lượng huỳnh quang và nó liên kết với tất cả DNA chuỗi kép. Khi SYBR Green Ⅰ được thêm vào hệ thống phản ứng PCR, nó sẽ liên kết với DNA sợi đôi trong quy trình, do đó tạo ra tín hiệu huỳnh quang. Như vậy, tổng tín hiệu huỳnh quang phát ra trong phản ứng khi đó sẽ tỷ lệ thuận với lượng DNA sợi đôi trong phản ứng và cường độ huỳnh quang sẽ tăng khi sản phẩm tăng. Tuy nhiên, do thuốc nhuộm liên kết không đặc hiệu với DNA sợi đôi nên có thể tạo ra kết quả dương tính giả.
Ưu điểm: giá tương đối thấp; dễ sử dụng; không lựa chọn mẫu DNA, tính linh hoạt tốt; độ nhạy phát hiện cao.
Nhược điểm: có thể cho kết quả dương tính giả; yêu cầu phân tích đường cong nóng chảy để xác định tính đặc hiệu của sản phẩm khuếch đại; yêu cầu tối ưu hóa liên tục hệ thống phản ứng để giảm sự khuếch đại không đặc hiệu; không phù hợp với nhiều xét nghiệm qPCR.
b. Phương pháp đầu dò huỳnh quang (công nghệ TaqMan): Đầu dò TaqMan là phương pháp đầu tiên được sử dụng để định lượng và là xét nghiệm được sử dụng phổ biến nhất trong thử nghiệm lâm sàng. Quá trình khuếch đại PCR được thực hiện bằng cách thêm một cặp mồi cùng với đầu dò huỳnh quang cụ thể. Đầu dò là một oligonucleotide được đánh dấu bằng nhóm phóng huỳnh quang (Reporter, R) ở đầu 5′ và nhóm chất khử (Quencher, Q) ở đầu 3′. Khi đầu dò còn nguyên vẹn, tín hiệu huỳnh quang do nhóm phóng viên phát ra sẽ được nhóm chất khử hấp thụ đến mức không thể phát hiện được tín hiệu huỳnh quang; trong khi khi PCR khuếch đại (trong giai đoạn mở rộng), đầu dò bị suy giảm do hoạt động exonuclease 5’→3′ của enzyme Taqase, do đó nhóm báo cáo và nhóm chất khử chất khử bị tách ra và huỳnh quang phát ra từ đáy của báo cáo nhóm sẽ không bị hấp thụ nữa, do đó tín hiệu huỳnh quang có thể được nhận trong hệ thống giám sát huỳnh quang. Nghĩa là, mỗi lần khuếch đại DNA sẽ tạo thành một phân tử huỳnh quang và quá trình hình thành các sản phẩm PCR hoàn toàn đồng bộ với quá trình hình thành các phân tử huỳnh quang. Càng nhiều sản phẩm PCR thì tín hiệu huỳnh quang tích lũy càng nhiều và cường độ huỳnh quang càng lớn.
Ưu điểm: độ đặc hiệu cao của phát hiện; độ nhạy cao; thích hợp để phát hiện nhiều qPCR; không cần xử lý hậu PCR, tiết kiệm thời gian và chi phí nguyên liệu đầu vào.
Nhược điểm: Các mẫu dò khác nhau cần được tổng hợp theo trình tự khác nhau; quá trình thủy phân của đầu dò phụ thuộc vào hoạt động của Taqase exonuclease và việc định lượng dễ bị ảnh hưởng bởi hiệu suất của thuốc thử và enzyme; rất khó để đánh giá các đặc tính khuếch đại thực tế từ kết quả xét nghiệm.
Lưu ý: PCR đa mồi, còn được gọi là PCR đa mồi hoặc PCR phức hợp, là một loại kỹ thuật khuếch đại PCR mới bổ sung nhiều hơn hai cặp mồi trong một hệ thống phản ứng để khuếch đại đồng thời nhiều đoạn axit nucleic.
3) Phiên mã ngược-PCR (RT-PCR)
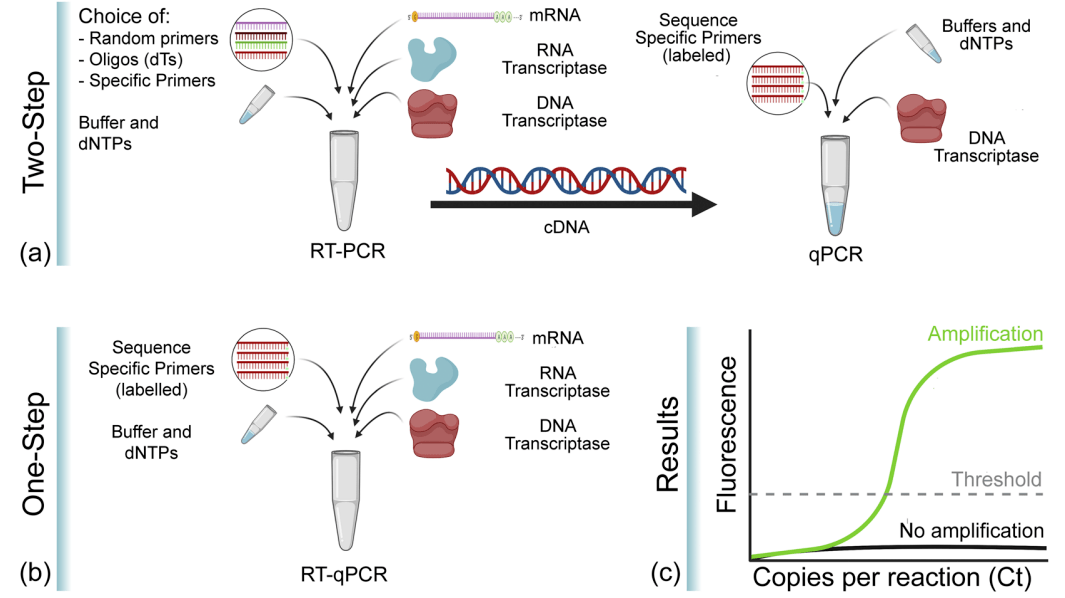
PCR sao chép ngược kết hợp sao chép ngược (RT) của RNA và khuếch đại chuỗi polymerase của cDNA, và là một biến thể PCR được sử dụng rộng rãi. Trong RT-PCR, RNA chuỗi đơn trước tiên được phiên mã ngược thành cDNA bằng enzyme phiên mã ngược, sau đó cDNA được sử dụng làm khuôn mẫu để khuếch đại và tổng hợp đoạn đích. RNA được sử dụng làm khuôn mẫu có thể là các sản phẩm RNA tổng số, mRNA hoặc RNA được phiên mã in vitro. Bất kể loại RNA nào được sử dụng, điều quan trọng là phải đảm bảo rằng RNA không có enzyme RNA và DNA bộ gen bị nhiễm bẩn. RT-PCR là một kỹ thuật nhạy và được sử dụng rộng rãi để phát hiện mức độ biểu hiện gen trong tế bào, mức độ virus RNA trong tế bào và để nhân bản trực tiếp trình tự cDNA cho các gen cụ thể. Nó thường được thực hiện bằng phương pháp một bước hoặc hai bước, trong đó phản ứng RT và phản ứng PCR được thực hiện trong cùng một ống, trong khi ở phương pháp hai bước, hai phản ứng được thực hiện riêng biệt và tuần tự.
4) RT-PCR thời gian thực (RT-qPCR)
RT-PCR thời gian thực là sự kết hợp giữa qPCR và RT-PCR, trong đó “RT” có nghĩa là Phiên mã ngược, do đó RT-qPCR là PCR phiên mã ngược kết hợp với công nghệ định lượng huỳnh quang, tức là mRNA hoặc RNA tổng số được sử dụng làm khuôn mẫu để thu được cDNA, sau đó cDNA được sử dụng làm khuôn mẫu để phân tích định lượng bằng phương pháp PCR định lượng huỳnh quang. RT-qPCR là PCR sao chép ngược kết hợp với định lượng huỳnh quang, có nghĩa là mRNA hoặc RNA tổng số được sử dụng làm khuôn mẫu để thu được cDNA, sau đó cDNA được sử dụng làm khuôn mẫu để phân tích định lượng bằng PCR định lượng huỳnh quang. Điều này là do RT-PCR chỉ có thể phân tích định tính chứ không thể phân tích định lượng. Giống như RT-PCR, có hai phương pháp phân tích định lượng RNA bằng RT-qPCR: phương pháp một bước và phương pháp hai bước. Cả hai phương pháp đều yêu cầu sao chép ngược RNA thành cDNA trước khi sử dụng nó làm khuôn mẫu để khuếch đại qPCR, ngoại trừ RT và qPCR trong phương pháp một bước được thực hiện trong cùng một ống nghiệm và RT và qPCR trong phương pháp hai bước được thực hiện riêng theo thứ tự.
5)PCR kỹ thuật số (Dig-PCR, dPCR)
PCR kỹ thuật số, hay PCR thế hệ thứ ba, là một cải tiến khác so với PCR ban đầu, một kỹ thuật phát hiện chính xác cho phép định lượng tuyệt đối các axit nucleic. Dựa trên nguyên lý phân phối Poisson, các mẫu axit nucleic được phân phối thành một số lượng lớn các đơn vị phản ứng vi mô độc lập, song song (nâng cấp nano) sao cho mỗi buồng phản ứng trung bình chỉ chứa một bản sao hoặc không có phân tử DNA mục tiêu, sau đó là một phân tử huỳnh quang. tín hiệu được thêm vào để khuếch đại, nhờ đó đạt được số lượng tuyệt đối các phân tử axit nucleic mục tiêu và cải thiện độ nhạy và độ chính xác phát hiện.
4. Kết luận
1) PCR thường được gọi là PCR thông thường, khuếch đại DNA sợi đôi một cách định tính bằng cách sử dụng DNA sợi đôi làm mẫu và dNTP làm chất nền.
2) qPCR và PCR thời gian thực đề cập đến PCR định lượng, định lượng DNA được khuếch đại bằng cách sử dụng cDNA làm mẫu và dNTP làm cơ chất.
3) RT-PCR đề cập đến PCR phiên mã ngược, khuếch đại DNA bằng cách sử dụng cDNA phiên mã ngược từ mRNA làm mẫu và dNTP làm cơ chất, và thuộc một biến thể của PCR. Kết quả chỉ có thể là chất lượng chứ không phải số lượng.
4) RT-qPCR là phương pháp PCR định lượng phiên mã ngược, là sự kết hợp của qPCR+RT-PCR, trong đó RNA tổng số hoặc mRNA được phiên mã ngược thành cDNA và sau đó được sử dụng làm mẫu để phân tích định lượng bởi qPCR với dNTP làm cơ chất.
Tài liệu tham khảo:
Cao Y, Yu M, Dong G, et al. Digital PCR as an Emerging Tool for Monitoring of Microbial Biodegradation. Molecules. 2020,25(3).
Lee NY. A review on microscale polymerase chain reaction based methods in molecular diagnosis, and future prospects for the fabrication of fully integrated portable biomedical devices. Mikrochim Acta. 2018,185(6).
Soler M, Scholtz A, Zeto R, et al. Engineering photonics solutions for COVID-19. APL Photonics. 2020,5(9).